如何開一家口罩廠?口罩廠需要辦理哪些手續��?
 來源:天氏庫力 發布日期
2020-11-05 瀏覽:
來源:天氏庫力 發布日期
2020-11-05 瀏覽:
口罩廠需要五個最基本的要素:醫療器械生產企業許可證��、無塵生產車間���、生產所需原材料���、口罩/包裝/滅菌生產線以及口罩檢測設備�。特別需要注意���,檢測設備也是需要剛開始就準備的�,并不是后期才需要準備的����,不然證書無法下來。
接下來我們就如何辦理一家口罩廠��,梳理了一下流程���,具體步驟如下:
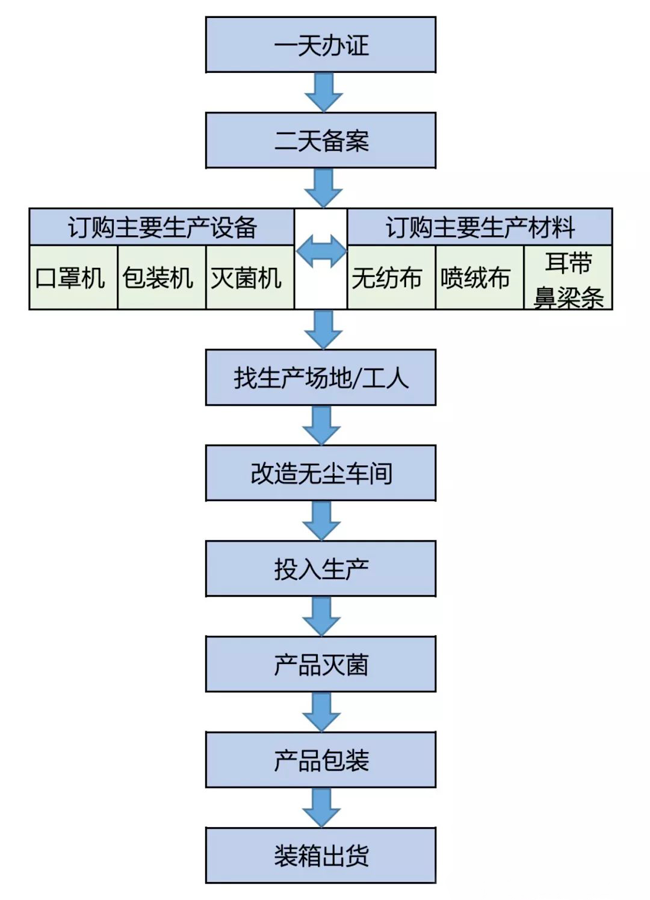
口罩廠辦理流程圖
生產口罩的類型有哪些�����?
口罩有不同種類�����,我們此處主要關注的是醫用口罩�����。
醫用口罩屬于第二類醫療器械��,必須取得藥品監督管理局頒發的注冊證才可銷售�,監管比較嚴格。不僅能夠用于醫療機構使用�,普通人也更愿意購買醫用口罩。因此����,目前想生產口罩的企業基本都希望能夠獲得醫用口罩的市場準入。

醫療器械生產許可證書
醫用口罩分為如下三類:醫用普通口罩(一次性使用醫用口罩)���、醫用外科口罩和醫用防護口罩,其防護能力由低到高�,生產的難度也有區別。
其中一次性使用醫用口罩可以分為無菌和非無菌兩種包裝�。無菌包裝比非無菌包裝更有難度,而且環氧乙烷滅菌需要約14天的解析時間����,無菌檢查也需要將近20天的時間,因此整體花費的時間也更長���。
按照面罩形狀可以分為平面形�����、鴨嘴形�、拱形或折疊式等。按照佩戴方式可以分為耳掛式���、綁帶式或頭帶式�。因此���, 企業需要先根據自身的能力以及能夠承受的時間�����、金錢投入來決定生產哪一種醫用口罩��。
不同類別的口罩從原材料���、生產工藝、檢驗要求等方面都有差別�,如果一開始不確定好,會浪費很多時間�����。
口罩的原材料主要有哪些?
主體材料:常見的醫用口罩�,主要由三層無紡布組成。內層是普通無紡布�����;外層是做了防水處理的無紡布��,主要用于隔絕患者噴出的液體����;中間的過濾層用是聚丙烯熔噴無紡布(有的經過駐極處理,靜電駐極能提高過濾效率�����、降低過濾阻力也有所下降�����, 甚至對纖網的均勻性也有所改善����。)
其他材料包括金屬(用于鼻夾)、染色劑���、彈性材料(用于口罩帶)等�。其中起到主要作用的是主體過濾材料PP熔噴布���。平面型口罩濾材的主要性能指標為細菌過濾效率BFE�,過濾級別有:普通級�����、BFE95(濾效95%)����、BFE99(濾效99%)、VFE95(濾效99%)�、PFE95(濾效99%)、KN90(濾效90%)���。
企業應根據所要生產的口罩種類選擇濾材的過濾效率以及克重�����。例如一次性醫用口罩一般選擇20g/m²的BFE95熔噴布�,但是N95口罩一般用40g/m²,防護效果更好���。
選擇濾材供應商時應注意索要濾材的BFE過濾效率報告����,目前國際上比較公認的機構有美國NELSON(尼爾森試驗室)和NIOSH(美國職業安全與健康國立研究所)�。
此外,如果生產醫用口罩�,應關注原材料的生物學相容性。如果供應商能夠提供原材料的 生物學試驗報告(細胞毒�、皮膚刺激、遲發型超敏試驗)�����,將能節省口罩成品的生物學評價的時間及費用��。
歐洲 EN ISO 14683:2014以及ASFM F2100的口罩濾材的標準分別如下表所示����,供參考:
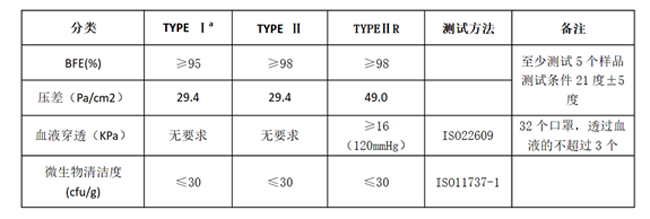 歐洲 EN ISO 14683:2014標準
歐洲 EN ISO 14683:2014標準
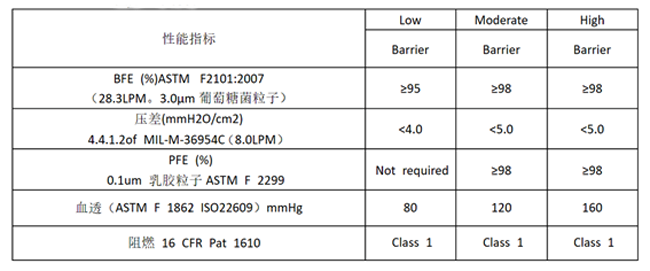 美國ASFM F2100標準
美國ASFM F2100標準
口罩檢驗要求:
醫用口罩產品的檢測包括出廠檢驗和型式檢驗。出廠檢驗項目至少應有以下項目:外觀���、結構與尺寸�、鼻夾��、口罩帶���、微生物指標����、環氧乙烷殘留量(若采用環氧乙烷滅菌) 的要求�。其他還有些重要的指標例如細菌過濾效率、通氣阻力���、顆粒物過濾效率���、密合性等。
考慮原材料的進貨檢驗以及口罩的出廠檢驗�,企業應配置基本的檢驗儀器,如電子天平����、測力計、千分尺��、游標卡尺、直尺�����、白度儀等����。如果微生物指標和環氧乙烷殘留量均自檢,則需要有微生物實驗室及相應的儀器��。
口罩檢測設備:
口罩檢測設備大多采用蘇州天氏庫力精密儀器有限公司生產的口罩一系列檢測儀器���。目前����,蘇州天氏庫力的口罩及防護器材檢測設備包含口罩細菌/顆粒物/病毒過濾效率檢測儀���、口罩呼吸阻力測試儀����、通氣阻力測試儀���、合成血液穿透測試儀�、阻燃測試儀、耳帶強力測試機����、恒溫恒濕試驗箱��、氣象色譜儀�、顆粒物防護效果測試儀等。(更多口罩檢測設備資料參數請參考口罩檢測設備專欄���,網址:http://fyqpxh.com/yiliao/)

常見的幾種口罩檢測設備
廠房設置及生產設備:
無菌口罩一般要在10萬級潔凈車間生產�����。如果企業新建潔凈廠房是一筆不小的投入���,時間上也不一定來得及?���?谡值纳a一般是全自動或者半自動的。
全自動設備包括全自動平面口罩機��、全自動折疊口罩機等���。全自動設備較貴��。
半自動的設備包括:口罩成型機����、口罩壓合機、口罩切邊機�、呼吸閥沖孔機(若有呼吸閥)、鼻梁條線貼合機�、耳帶點焊機、呼吸閥焊接機(若有呼吸閥)����,一般全套大概要50萬左右。
需要注意的是����,如果生產無菌醫用口罩,則會涉及到滅菌工序�。目前絕大部分企業選擇的是環氧乙烷(EO)滅菌。很少采用輻照滅菌����,據說輻照滅菌可能導致細胞過濾效率不通過。
如前文所說��,環氧乙烷滅菌的口罩需要進行解析。因為環氧乙烷滅菌后����,口罩上會有環氧乙烷殘留,而環氧乙烷是一種有毒的致癌物質���,長期吸入環氧乙烷,不但刺激呼吸道��,還會有致癌可能性����。長期少量接觸,可見有神經衰弱綜合征和植物神經功能紊亂����。因此,經環氧乙烷滅菌的醫用口罩��,必須經過解析 釋放口罩上殘留的環氧乙烷����,經檢測合格才能出廠上市。大部分企業經過驗證的環氧乙烷解析時間大約是14天�����,能確保口罩中殘留的環氧乙烷含量低于10ug/g的安全標準���。
另外���,環氧乙烷滅菌的口罩應選用透氣的內包裝材料。否則環氧乙烷難以穿透�����,難以達到滅菌效果�����。
質量管理體系及注冊資料:
如果要申報醫用口罩����,則必須建立符合《醫療器械生產質量管理規范》的質量管理體系,并且按照要求編寫相應的應急備案資料或者注冊管理資料�����,還要經過現場核查��。對于無醫療器械行業從業經驗的企業來說,這是不小的挑戰����。其中涉及的要求非常多,此處不一一贅述�����。
最后不得不提的就是市場了�����,那么我們選用哪一種市場準入方式更合適呢�����?
企業想要生產一次性使用醫用口罩�,但又擔心投入的成本打水漂���,因此希望能夠盡快獲得市場準入�。綜合目前市場上的各類途徑來看�����,總體可分為如下四條路徑:
1. 民用口罩
2. 出口轉內銷
各地藥監局均發布了出口醫療器械轉內銷的綠色通道,對于原來生產國外標準口罩用于出口���,有能力生產國內標準口罩����,卻未取得相關資質的企業�����,可以通過這些綠色通告迅速取得市場準入����,從而銷往醫療機構,供應急使用�。
3. 生產應急醫療器械產品備案
很多非醫療器械企業或者原先沒有生產出口口罩的企業也想建立口罩生產線。難度會更大一點�����,但有些藥監局有生產應急醫療器械產品備案的程序����,可以幫助這些企業快速取得產品備案,例如江蘇省就有這樣的政策。但對這些企業來說�����,新建一條生產線�,并且建立基本的質量管理體系,通過藥監局的現場檢查并不容易��。需要有熟悉醫療器械行業的人員指導�����,并與藥監人員密切溝通����,及時整改。
此條路徑與“出口轉內銷”路徑雖然整體難度不大�����,時間也相對短��,但是取得的備案憑證有效期不會太長���,基本只能用于疫情期間使用。
4.取得第二類醫療器械注冊證
以一次性使用醫用口罩為例,統計了上述路徑的難易程度��、所需時間����、優缺點,見下表����。
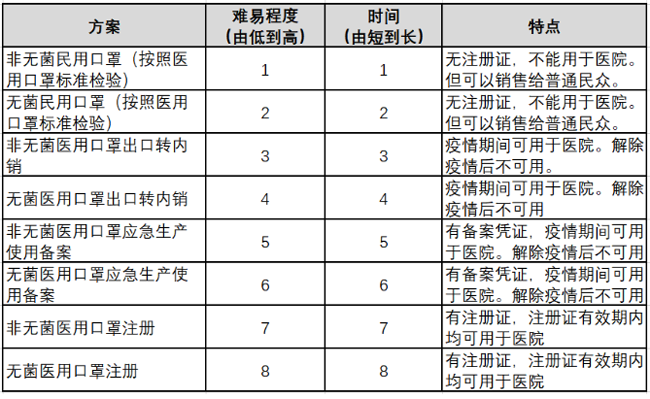 第二類醫療器械注冊證辦理難易表
第二類醫療器械注冊證辦理難易表
推薦閱讀
【本文標簽】:如何開一家口罩廠,口罩廠辦理手續
【責任編輯】:天氏庫力 版權所有:http://fyqpxh.com/轉載請注明出處

 來源:天氏庫力 發布日期
2020-11-05 瀏覽:
來源:天氏庫力 發布日期
2020-11-05 瀏覽:




